【提供合成生物学与微生物科研课题合成生物学实验外包服务】
至善北京健康医学研究院咨询电话:18514511311
合成生物学的核心是利用工程学思维方式构建执行特定生物学功能的目标人造复杂生物系统。肿瘤等重大疾病发病机制复杂,异质性高,通过逻辑基因线路调控的复杂生物系统具有更高的解决复杂系统问题的能力。目前,合成生物学正在生物设计、医疗健康、工业化学品、生物燃料、食品及饮料等各个方面展现其应用潜力。设计·构建·测试·学习循环(DBTL)是合成生物学药物开发的核心研发模式,快速开发、筛选高效药物产品。
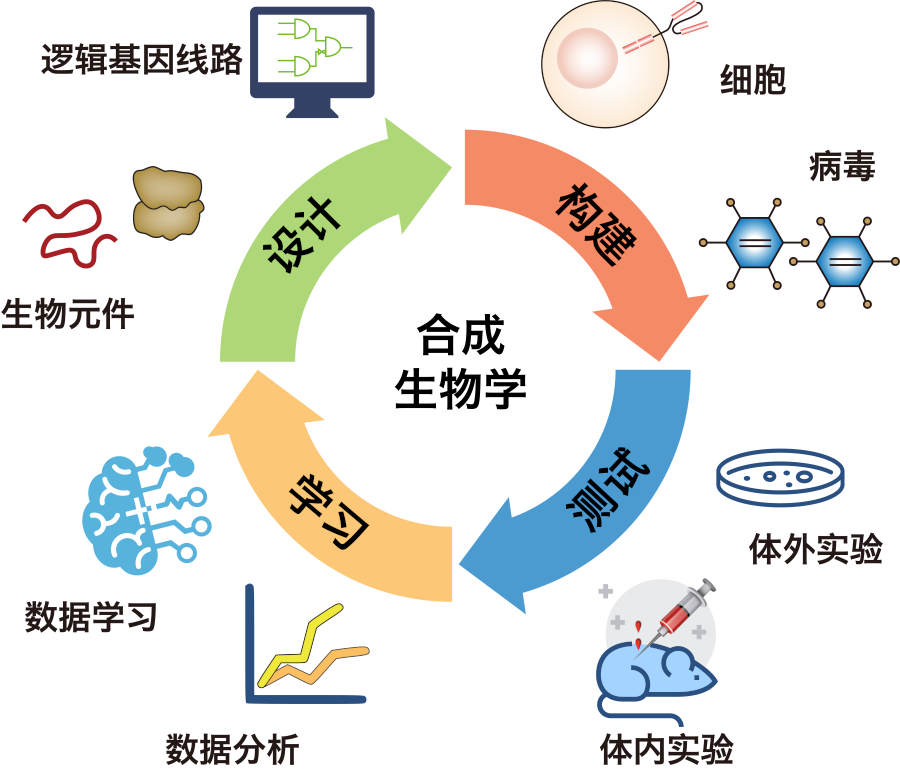
合成生物学是一门,设计和构建新的生物实体,或者通过对遗传信息进行重新编程来重新设计现有生物系统的学科。自20世纪60年代开始发展,但在过去10年中发展尤为迅速,这主要是因为DNA合成成本的急剧下降、基因工程的进步以及科学家对基因组学和数据科学的更好理解。
长期以来,速度、成本和质量一直是控制制药行业生产力的基本要素。以提高药物发现效率为重点,这三个要素是合成生物学工具应用的关键。然而,打破规则提高药物发现速度,需要与基于实验室的经典「设计-制造-测试」循环完全不同的方法。虽然人工智能和自动化化学的应用在制药行业得到了强有力的支持,但合成生物学在基于工具的进步之外的潜在应用未被重视,更没有得到特别认可。
合成生物学中的工程生物(Synthetic Biology Chassis Organisms)
合成生物学当前应用最广泛最成熟的工程生物,原核主要是大肠杆菌,真核主要是酿酒酵母;工程生物的优势在于易培养、发酵周期短。目前已经广泛应用于各类药物蛋白的表达,各类抗原抗体的生产,各类药用次级代谢产物。还有其他的工程生物,比如枯草芽孢杆菌,拥有高分泌酶和某些营养品的生产能力;乳酸菌、毕赤酵母用于治疗蛋白质生产;链霉菌,用于生产大量天然产品,包括聚酮酸、非核糖体肽(NRPs)和萜烯。
合成生物学对药物研发过程的影响
Target Validation 当前困扰药物项目的主要因素在于目标的识别与验证。因此,发现新目标并对其进行验证是建立正确药物研发流程和确保未来医学进步的重要组成部分。基因编辑工具CRISPR-Cas9,刚好可以应用于该领域。凭借精准修改基因序列的能力,该技术允许生成几个新的目标验证组件,这些组件有望在选择正确的目标方面提供显著优势。
有了基因编辑技术,科学家可以设计精准的细胞模型,可以跨细胞对基因的表达进行上调或下调,也可以通过突变来改变基因的功能。此外,CRISPR-Cas9 可以构建具有消除基因功能的全基因组筛选集,该筛选集可用于快速检查这些基因在不同细胞模型中的作用;这些功能有利于发现新的细胞通路,为疾病治疗、药物发现提供新的选择途径。
CRISPR 领域正在爆炸式增长,对目标识别和验证产生深远影响。现代药物发现过程的测定方法的发展,很大程度上归功于通过生物电路工程设计的合成生物学。
Assay Development:筛选中的生物传感器和遗传选择 使用合成生物学以正交和可预测的方式重编程细胞,为药物发现过程提供了许多解决方案。前期的研究已经成功创建,可以遵循数字逻辑、动态的、甚至可以模仿电子设备的基因电路。这些电路可以为各种输入(例如小分子或代谢物)提供可筛选、可选择的输出,并可作为生物测定和生物传感器纳入药物发现过程用于表型筛选。随着越来越多的生物信息被发现,合成细胞系统的复杂性将会增加,与之相随它们的计算能力也会增加。同时,人工智能技术的应用,可以使该工具发挥更大的优势。
Hit Generation 虽然天然产物历来是一种非常成功的药物来源,但现代药物发现过程已将重点放在高度精选的化合物库的 HTS 上,以寻找药物先导物。在这样的筛选中,合成工程生物测定对于Hit的发现过程是隐含的。HTS可以筛选非常大的药物前导物和小分子库,从而找到适合药物化学优化的Hit,在某种程度上比天然产物中寻找药物要高效很多。
基因组序列的可用性、数据科学和合成生物学的结合使得基因组挖掘能够催化天然产物药物发现的复兴。在组合生物合成中,生物合成基因簇 (biosynthetic gene clusters,BGC) 的成分被置换,可以允许进一步的生物合成多样化,从而避开困难的化学合成。人工智能和机器学习也许能够增强BGCs的重构,以增加形成新分子的可预测性。
先导优化(Lead Optimization):定向进化与合成生物学 Hit identification和lead generation之后是先导优化。在这个过程中,初始先导化合物需要经过反复的(化学)修饰和表征,从而深入了解它的结构-活性关系和代谢稳定性。传统药物研发过程中不断地迭代修饰与合成生物学中的定向进化可以说是有异曲同工之妙。利用定向进化对药物蛋白进行修饰,是当前生物制药的重要手段。
同时,定向进化耦合基因编码库、突变和选择压力已经彻底改变了治疗性抗体的发展。定向进化与生物回路的耦合,允许体内定向进化用于药物发现和具有新功能的新蛋白质的进化。工程酶已经用于批量药物生产的各个步骤,并且整个途径都可以用于生物合成生产。逐步定向进化已经取得了成功,连续定向进化可以探索更多信息,从而可以在结构-活动空间中进行更深入的搜索。
使用工程酶对药物先导物进行后期 C-H 功能化 在早期药物发现过程中,可以通过选择性添加、缺失或者替换特定原子来对生物活性分子进行结构修饰。这一过程被称为后期功能化 (late-stage functionalization,LSF)或分子编辑,在生成药物先导类似物库方面,通常比从头合成更快、更具成本效益。因此,LSF在加速发现具有优化活性、安全性、药物代谢/药代动力(DMPK)特征的药物先导化合物方面具有很大的潜力。
酶催化是重要的药物先导物修饰方式。合成生物学可以通过设计酶的相关结构,定向改变工具酶的性质。同时,机器学习人工智能可以帮助优化工具酶设计的准确性。利用合成的工具酶对药物先导物进行处理,将大大提高药物先导物的利用率。
细胞疗法与生物制剂
未来合成生物学的灵丹妙药可能是能够控制患者细胞在体内的行为方式。去除、修饰和替换这些细胞的能力已经在肿瘤治疗中成为现实。通过 CAR-T 细胞疗法,人体自身的免疫系统可以重新编程以寻找和摧毁癌细胞。合成生物学可以进一步增强 CAR-T 细胞的特殊性和时间性。
利用细胞治疗会比全身治疗更有效地利用药物。传感器执行器电路的产生提供了一种新的可能性,即可以生产细胞来替换或修复有缺陷的细胞过程。一系列动物实验表明,细胞药物即将能够转化为恶劣疾病的治疗改进措施。同时,利用工程细菌系统来治疗癌症也是不错的思路。
总结与展望
合成生物学对药物的发现阶段、开发阶段和生产阶段都有影响。合成 DNA 成本的急剧下降,对基因组、基因调控以及工程生物可用性的日益深入的了解,是迄今为止成功和未来潜力的基础。人工智能、机器学习等现代技术与合成生物学、化学等现代技术的融合,将进一步推动药物发现与研发技术的发展和进步。