【大小鼠脑立体定位注射AAV慢病毒腺病毒注射动物实验服务】
提供北京专业优质大小鼠脑室海马脑立体定位注射AAV慢病毒腺病毒脑立体定位注射实验外包委托技术服务:
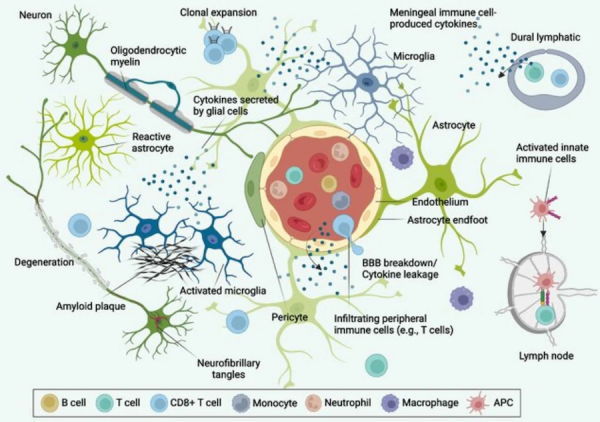
脑立体定位注射仪是神经解剖、神经生理、神经药理和神经外科等领域内的重要研究设备,利用颅骨表面的标志(如前囟点)为基本参考点,通过三维移动来确定动物大脑皮层下某神经结构(核团)的位置,进而完成对神经结构进行定向的脑立体定位注射、刺激、破坏、引导定位等操作,可用于帕金森氏病动物模型建立、癫痫动物模型建立、脑内肿瘤模型建立、学习记忆、脑内神经干细胞移植、脑缺血等研究。
小鼠侧脑室脑立体定位注射给药的,用的是人的Aβ1-42,深度为颅骨表面向下2.5mm,下面资料上是2mm.处,一般都用的是人的Aβ,用25-35Aβ的便宜用大鼠的Aβ好像没听说过.

Aβ致痴呆模型
一、Aβ海马脑立体定位注射致脑内神经炎性反应模型的制备
(1)脑立体定位注射实验材料
动物:SD大鼠,200~250g;NIH小鼠,18~20g
试剂:Aβ1-40/Aβ25-35为美国Sigma公司产品,麻醉药
仪器:脑立体定位仪
(2)脑立体定位注射实验步骤
Aβ1-40/Aβ25-35肽段大鼠海马内注射:SD大鼠1%戊巴比妥钠麻醉,固定于脑立体定位仪上,头顶部去毛,消毒皮肤,头顶部正中切口,暴露前囟,按大鼠脑立位图谱,于前囟后3.0mm,中线右侧2.0mm处,微量注射器自脑表面垂直进针2.8mm,向双侧海马缓慢注入5μl(2μg/ul,用无菌生理盐水溶解Aβ肽段完之后分装,-20度保存,用的时候取出一管37度孵育7天),每侧注射时间5min, 留针2min,缓慢退针。所有操作均在无菌条件下进行,皮肤切开处用青霉素抗菌,缝合伤口。假手术组注射等量生理盐水。
Aβ1-40/Aβ25-35肽段小鼠海马内注射:立体定向仪固定小鼠(bromega 2.3mm, L:1.8mm, V:2.0mm),根据所需注射部位,按小鼠脑立体定向定位,在钻孔后注射5ul,速度0.2ul/15秒,注射完毕后留针2min,然后每分钟退针1mm。整个注射过程不到10min,注射效果好,小鼠很快从麻醉(气体)中恢复。
(3)脑立体定位注射注意事项:
1、海马与记忆功能有关,AD患者住住以记忆障碍为首发症状,这与疾病早期海马的损害有关,将Aβ肽段注射入海马区,可模拟AD发病过程。推荐使用Aβ1-40,但Aβ25-35也是引起细胞毒炎性反应的重要肽段,且价格便宜,溶解性好。
2、固定头颅时一定要准确插入双耳固定棒,不能太紧,也不能靠颈部,这样容易刺激迷走神经而引起呼吸停止,难以抢救,
3、钻孔时一定要控制好,宁慢勿快,很容易在颅骨钻通后一不小心钻头进入脑组织。
4、麻醉很关键。腹腔注射药物剂量不好掌握,药物用多了小鼠死亡率很高,鼠在手术过程中稍有挣扎,就会对定位有影响,且对操作不利。
二、Aβ脑室内注射致痴呆模型的制备
(1)脑立体定位注射实验材料
动物:SD大鼠,200~250g;NIH小鼠,18~20g.
试剂:Aβ1-40/Aβ25-35为美国Sigma公司产品
仪器:脑立体定位仪
(2)脑立体定位注射实验步骤
Aβ1-40脑室注射大鼠:SD大鼠经腹腔注射10%的水合氯醛(0.4g/kg体重)麻醉后,固定于脑立体定位仪上,头顶部去毛,消毒皮肤,头顶部正中切口,暴露前囟,按大鼠脑立位图谱,向实验组大鼠第三脑室注射Aβ 5μl(2μg/ul,处理方法见前面所述),脑室立体定向坐标为:AP=-1mm,VD=4.5mm;微量注射器自脑表面垂直进针2.6mm,正常对照组为等量生量盐水,其它处理方法见前面所述。
Aβ1-42脑室注射小鼠:用0.2mL0.4%戊巴比妥钠麻醉小鼠,将小鼠固定在定位仪上,剪开头顶部皮肤,酒精棉擦拭,暴露出前囟。采用右侧脑室定位,自前囟向后2mm,矢状缝旁开1.5mm处,即为侧脑室的体表部位。用微量注射器在此位置穿一小孔,深度为颅骨表面向下2.5mm处,每只小鼠以2μl/min恒速注射1.5μlAβ(2μg/ul)。生理盐水组小鼠注入1.5μL生理盐水代替Aβ。术后24h开始各组分别给予药物治疗,按每天每只小鼠0.2mL药液灌胃,生理盐水对照组为0.2mL生理盐水。
(3)脑立体定位注射注意事项:
1、有细胞毒的可溶性Aβ进入脑室,经侧脑室弥漫致全脑,更接近Aβ引起细胞毒作用的实际过程,推荐使用小鼠注射Aβ1-40,其较大鼠造模简单,Aβ用量少造价低。
2、给药时间:(1)术前给药一周,术后给药一周(2)术后24小时
---------几点说明------------
1.Aβ1-40是用无菌生理盐水还是双蒸水溶解的关键是看你实验的对照组海马或者其他部位注射的是无菌生理盐水还是双蒸水,如对照组用无菌生理盐水,那就用无菌生理盐水溶解,因为只有这样才有对照的意义。溶解的浓度要看你买回试剂的时候配置来调节。一般的制作AD模型时,每侧海马注射10ug,我的Aβ25~3 5(购于Sigma公司)用无菌生理盐水配制成2ug/uL,37℃下孵育一周,使其变为凝聚态Aβ25~35。,每侧海马注射5ul。
2.Aβ1-40的注射部位,用的是海马或者侧脑室都可以,都有大量的文献报道模型制作成功,主要看你们实验室的习惯在哪个部位。不过我个人认为,注射在海马比较好,因为如果注射在侧脑室容易与脑脊液相溶,影响制作模型的成功。注射海马部位,Aβ停留在脑组织,易于吸收,模型易于成功。
3.注射量10ug就可以了,量多其不是浪费。再说Aβ并不便宜。不过用于细胞的模型量就不一样了。比如pc12细胞。
4.Aβ1-40溶解后的保存问题,用无菌生理盐水或者双蒸水溶解完之后分装-20度保存,用的时候取出一管37度孵育7天。孵育的目的是让Aβ25~3 5老化,使其变为凝聚态Aβ25~35。因为只有凝聚态Aβ25~35才能使AD模型制作成功。
【专业大小鼠动物实验脑立体定位注射AAV慢病毒腺病毒实验外包技术服务】

脑立体定位注射提供帕金森(PD)、阿尔兹海默症(AD)、慢性疼痛等神经系统疾病研究一站式服务项目,主要包括模型构建、行为学实验及相关药效评价等。
玻璃体腔注射 玻璃体腔: AAV-Syn-GcaMP6s
脊髓注射可作为研究神经系统药物等对脊髓直接作用的手段,所给药物等可局限于脊髓不同节段,清楚地区分药物等对不同节段的作用。
至善研究院为您的神经科学研究助力。